Chirurgia oculistica
Cataratta
Glaucoma
Degenerazione maculare senile (DMS)
Interventi chirurgici sul corpo vitreo
Interventi chirurgici sulla congiuntiva
Interventi chirurgici per lesioni
Interventi chirurgici sulle palpebre
Chirurgia delle vie lacrimali
Chirurgia tumorale
Glaucoma
PD Dr. med. Karl-Georg Schmidt
Definizione
Il
glaucoma è una malattia del nervo ottico che costituisce una delle più
frequenti cause di cecità nelle nazioni industrializzate. Il glaucoma ha
un decorso per lo più indolore, lento e inizialmente asintomatico. La
caratteristica tipica è una continua e irrimediabile perdita di fibre
del nervo ottico. Queste fibre nervose sono responsabili della
trasmissione degli stimoli visivi al cervello. Quante più fibre nervose
sono degenerate, tanto meno stimoli visivi inviano gli occhi al cervello
per l'elaborazione delle immagini. La conseguenza sono deficit del
campo visivo caratteristici, che portano a cecità, qualora non vengano
trattati.
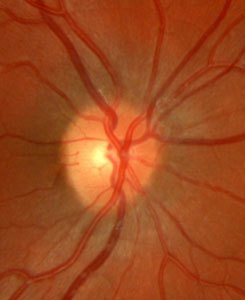
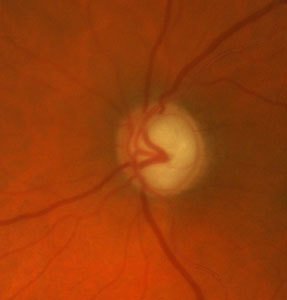
Nello stadio avanzato questa perdita di fibre del nervo
ottico è riconoscibile sotto forma di crescente escavazione a livello
della papilla ottica.
Anatomia
Dal
punto di vista anatomico si distinguono glaucomi ad angolo aperto e ad
angolo chiuso. Questa classificazione si basa sull'angolo tra superficie
posteriore della cornea e superficie anteriore dell'iride. Nel
cosiddetto angolo irido-corneale si trova il sistema trabecolare,
attraverso il quale l'umore acqueo abbandona l'occhio attraverso il
canale di Schlemm.
Il glaucoma ad angolo aperto è di gran lunga il
più frequente, ha in genere un decorso di diversi anni ed è indolore,
per cui di frequente non viene scoperto, mentre i più rari glaucomi ad
angolo chiuso possono causare un attacco di glaucoma acuto doloroso che,
se non trattato, può causare cecità in breve tempo.
Incidenza
In Svizzera il glaucoma è una delle più frequenti cause di cecità. Dopo i 40 anni due persone su cento si ammalano di glaucoma, ed è stato dimostrato che il glaucoma causato dall'eccessiva pressione intraoculare affligge 50.000 svizzeri, il 10 percento dei quali è minacciato da cecità. In questo studio non sono compresi i pazienti con glaucoma e pressione intraoculare normale (glaucoma a pressione normale, circa il 30-45% di tutti i glaucomi). La Società Svizzera di Oftalmologia (SSO) fa presente che le cifre non ufficiali per questa malattia sono molto elevate. Si suppone che in Svizzera il glaucoma colpisca complessivamente circa 100.000 persone.
Pressione intraoculare
Nel
corpo ciliare dell'occhio viene prodotto l'umore acqueo, che viene
rilasciato nella camera posteriore dell'occhio. Attraverso la pupilla
passa poi nella camera anteriore dell'occhio e fluisce attraverso il
sistema trabecolare nel canale di Schlemm. Il rapporto fra produzione di
umore acqueo e suo deflusso condiziona la pressione intraoculare.
Il valore normale della pressione intraoculare è compreso fra 10 e 21
mmHg, considerando normali oscillazioni giornaliere fino a 5 mmHg. Negli
europei la pressione intraoculare cresce con l'aumentare dell'età.
Cause
Una
delle cause del glaucoma ad angolo aperto è un disturbo cronico della
circolazione sanguigna del nervo ottico, che spesso è determinato da un
aumento della pressione intraoculare, dovuto a sua volta a un disturbo
del deflusso dell'umore acqueo dalla camera anteriore dell'occhio. La
maggior pressione all'interno dell'occhio viene esercitata anche sulle
sensibili fibre del nervo ottico. Particolarmente vulnerabile risulta la
papilla ottica, ossia il punto in cui convergono tutte le fibre nervose
della retina per abbandonare l'occhio e dirigersi verso il cervello. Se
in questo punto le fibre nervose non vengono più rifornite con una
quantità sufficiente di ossigeno e di altre sostanze nutritive, muoiono
per carenza cronica di apporto nutritivo.
Se la papilla ottica viene
irrorata da una sufficiente quantità di sangue, può essere tollerata
una superiore pressione intraoculare, mentre con irrorazione sanguigna
deficitaria anche una pressione intraoculare bassa può far progredire il
glaucoma (glaucoma a pressione normale). Particolarmente sfavorevole è
l'associazione tra pressione intraoculare elevata e circolazione
sanguigna deficitaria a livello di papilla ottica. Dal momento che sia
la pressione intraoculare sia la circolazione sanguigna possono variare,
sono importanti sia il valore assoluto di entrambi i parametri sia la
durata delle condizioni sfavorevoli di pressione e circolazione.
Tutte le condizioni che contribuiscono a far aumentare la pressione intraoculare o a ridurre la circolazione sanguigna della papilla ottica possono quindi causare il glaucoma. Fra le prime vengono compresi soprattutto i disturbi della funzionalità del sistema trabecolare, la pressione arteriosa (troppo) bassa, l'ipertensione arteriosa non trattata e altre malattie che limitano la circolazione sanguigna (arteriosclerosi, aritmie cardiache, diabete mellito ecc.). Soprattutto le fasi con eccessiva riduzione notturna della pressione arteriosa possono contribuire a far peggiorare la malattia. La neurodegenerazione e lo stress ossidativo influenzano ulteriormente il quadro morboso.
La
combinazione individuale di questi fattori definisce la soglia critica
oltre la quale si osserva una progressione del glaucoma.
Il danno del nervo ottico caratteristico del glaucoma, riconoscibile sotto forma di una escavazione della papilla ottica, interessa dapprima le fibre nervose della periferia retinica media e progredisce lentamente verso il centro. Se è interessato circa il 70% delle fibre nervose, si formano limitazioni arciformi del campo visivo centrale, che spesso il paziente non percepisce anche in uno stadio avanzato.
La
pressione intraoculare può essere rilevata con diversi metodi
(tonometria ad applanazione secondo Goldmann, pneumotonometria). A
questo scopo si misura la forza necessaria per ottenere un appiattimento
definito (meccanico o pneumatico) della cornea, precedentemente
anestetizzata farmacologicamente. Il risultato della misurazione viene
influenzato dallo spessore della cornea del paziente. Se lo spessore
della cornea è maggiore o minore della norma, si osservano valori
rispettivamente superiori o inferiori a quelli effettivamente presenti.
Per questo motivo è necessaria un'aggiuntiva misurazione dello spessore
corneo, che, mediante applicazione di un fattore di correzione specifico
per la cornea, consente di calcolare la pressione intraoculare
effettiva sulla base dei dati grezzi dei valori di pressione misurati.
Dal momento che la pressione intraoculare oscilla durante la giornata,
possono essere necessarie diverse misurazioni distribuite nel corso del
giorno e della notte (profilo diurno e notturno).
La sola misurazione della pressione intraoculare non è sufficiente né per porre o escludere la diagnosi di glaucoma né per valutare il decorso della malattia. In aggiunta sono necessari i seguenti esami integrativi:
Misurazione della circolazione sanguigna del nervo ottico.
Misurazione
e valutazione del fondo oculare in immagini tridimensionali: l'entità
della lesione del nervo ottico viene determinata in base alla dimensione
e alla forma dell'escavazione della papilla ottica. Questi esami hanno
un reale valore se vengono ripetuti nel decorso della malattia, in
maniera da rendere possibile un aggiustamento precoce della terapia.
Esame del campo visivo: si ricercano difetti arciformi caratteristici del glaucoma.
Con questa denominazione si indica il glaucoma ad angolo aperto che si manifesta indipendentemente da altre malattie oculari.
Glaucoma cronico primario ad angolo aperto
Il glaucoma cronico primario ad angolo aperto è la forma più frequente di glaucoma. Tipicamente si manifesta dai 40 anni di età, ma può essere osservato anche prima. È nota l'importanza della predisposizione familiare (componente genetica). In questa forma di glaucoma si verifica un impedimento al flusso direttamente nel punto di deflusso dell'angolo irido-corneale dovuto ad alterazioni degenerative. La pressione nel bulbo oculare aumenta lentamente anno dopo anno, mentre il paziente in genere non ha disturbi.
Il glaucoma a pressione normale è una forma particolare del glaucoma cronico primario ad angolo aperto. In questo caso, nonostante i valori di pressione intraoculare siano prevalentemente normali, si sviluppa un danno progressivo del nervo ottico. A causa di diversi fattori, la circolazione sanguigna locale a livello di papilla ottica viene talmente limitata da danneggiare anche le fibre del nervo ottico.
Glaucoma congenito (giovanile)
I disturbi di sviluppo dell'angolo irido-corneale durante il periodo embrionale determinano un disturbo di deflusso dell'umore acqueo. Questa anomalia può manifestarsi in combinazione con altre malformazioni del corpo. L'aumento della pressione intraoculare può provocare l'ingrossamento mono- o bilaterale del bulbo oculare. Se si sospetta un glaucoma congenito, si deve condurre precocemente un esame con misurazione della pressione intraoculare ed eventualmente un intervento chirurgico per impedire la lesione del nervo ottico.
Glaucoma secondario ad angolo aperto
Se il glaucoma ad angolo aperto è conseguente ad altre malattie, si parla di glaucoma secondario ad angolo aperto. Questo disturbo si osserva in caso di lesioni o infiammazioni dell'occhio, tumori intraoculari e neoformazione di vasi sanguigni nell'angolo irido-corneale, per es. a seguito di diabete mellito o in persone con predisposizione specifica dopo assunzione di determinati medicamenti (per es. cortisone), ossia nei cosiddetti responder agli steroidi.
Glaucoma ad angolo chiuso
Il glaucoma ad angolo chiuso si forma per un disturbo del deflusso dell'umore acqueo dovuto a un angolo troppo stretto tra iride e cornea, vale a dire anteriormente al sistema trabecolare. L'entità del restringimento può variare, per es. per cambiamenti dell'ampiezza pupillare e, quindi, dello spessore dell'iride. Il disturbo del deflusso causa periodicamente o continuamente un aumento della pressione intraoculare, che in definitiva sfocia nella lesione del nervo ottico. Le persone con ipermetropia più accentuata (un occhio più corto significa un angolo irido-corneale più stretto) e cataratta in stadio avanzato (cristallino più spesso) costituiscono un gruppo a rischio. Determinati medicamenti (anticolinergici, per es. alcuni antidepressivi o antiemetici) possono indurre una dilatazione pupillare e, quindi, anche aumentare la pressione intraoculare, con la possibilità di scatenare un attacco di glaucoma acuto.
Attacco di glaucoma acuto
L'attacco di glaucoma acuto è il risultato di una riduzione improvvisa del deflusso dell'umore acqueo, dovuta all'occlusione dell'angolo irido-corneale da parte dell'iride. La conseguenza è un forte aumento della pressione intraoculare, per cui il bulbo oculare interessato offre spesso una consistenza elevata alla palpazione. Disturbi tipici: perdita della vista improvvisa, visione di anelli colorati contro luce, forti mal di testa, nausea, vomito ed eventualmente disturbi del ritmo cardiaco. Per lo più è interessato solo un occhio. L'attacco può regredire spontaneamente dopo poche ore anche senza trattamento e ripresentarsi periodicamente, ma può anche durare per giorni (senza essere notato).
Trattamento
Se
si accertano lesioni del nervo ottico tipiche del glaucoma, la terapia
deve ridurre in modo continuo la pressione intraoculare. In genere, le
lesioni del nervo ottico si manifestano per superamento cronico di una
pressione intraoculare critica, apporto deficitario di sostanze
nutritive (alterazione della circolazione sanguigna), neurodegenerazione
e/o eccessivo stress ossidativo. La pressione intraoculare critica è
diversa da persona a persona, e nel corso della malattia deve essere
prima determinata individualmente mediante stretti controlli e poi
abbassata in modo possibilmente duraturo grazie a un trattamento
appropriato. In aggiunta, occorre ottimizzare la circolazione sanguigna
del nervo ottico, controllare le malattie concomitanti (co-trattamento
internistico), rilevare le componenti neurodegenerative e ridurre lo
stress ossidativo. Lo scopo della terapia è quello di impedire la
progressione della malattia, anche perché i danni già presenti (difetti
del campo visivo) non sono più reversibili.
Il
trattamento inizia con le gocce oculari, che con diversi principi attivi
(beta-bloccanti, colinergici, alfa-simpaticomimetici, inibitori della
carboanidrasi, prostaglandine), da soli o in combinazione, riducono la
pressione intraoculare e in parte migliorano la circolazione sanguigna
del nervo ottico.
In caso di glaucoma secondario può essere necessario trattare in aggiunta la malattia di base.
Se
con la terapia farmacologica non si riesce a ridurre la pressione
intraoculare e migliorare la circolazione sanguigna in maniera
soddisfacente, si deve optare rapidamente per un trattamento
interventistico idoneo al paziente (laser, chirurgia).
Oltre a ciò, la pressione intraoculare può diminuire anche dopo esecuzione di un'operazione della cataratta, perché la lente di materiale plastico utilizzata presenta uno spessore inferiore a quello del cristallino naturale, per cui indirettamente si crea spazio a livello dell'angolo irido-corneale.
Prevenzione
Per
la prevenzione sono necessari esami oftalmologici presso l'oculista.
L'obiettivo è quello di diagnosticare la malattia in uno stadio precoce,
ossia prima che si instauri una compromissione funzionale. Grazie a un
trattamento tempestivo si può impedire nella maggior parte dei casi la
progressione della malattia e, infine, la cecità. Dal 40° anno di età ci
si dovrebbe sottoporre una volta all'anno a un esame di prevenzione. Un
esame di prevenzione più precoce è raccomandato in presenza dei fattori
di rischio seguenti:
- Ridotta circolazione sanguigna a livello di nervo ottico, che si riscontra spesso nei disturbi della circolazione sanguigna (vasospasmi) agli arti (mani o piedi freddi), nell’emicrania e nel tinnito
- Pressione intraoculare relativa o assoluta aumentata
- Età avanzata
- Miopia grave (glaucoma ad angolo aperto)
- Ipermetropia grave (glaucoma ad angolo chiuso e attacco di glaucoma acuto)
- Pressione arteriosa bassa od oscillante (glaucoma a pressione normale)
- Ipertensione arteriosa
- Predisposizione familiare
- Diabete mellito
Ulteriori informazioni
Per informazioni più dettagliate può consultare il nostro sito web, i link elencati oltre e i riferimenti bibliografici.Link a siti web
http://www.glaukompatienten.chInformazioni e linee guida sul glaucoma per i pazienti dell'Associazione professionale degli oftalmologi (APO) e della Società oftalmologica tedesca (DOG)
www.glaukom.de – Initiativkreis Glaukomfrüherkennung e.V.Croce verde tedesca: informazioni sul glaucoma e hotline glaucoma gratuita
Degenerazione maculare senile (DMS) PD Dr. med. Karl-Georg Schmidt
Definizione della DMS
La
degenerazione maculare senile (DMS) è una malattia degenerativa
progressiva degli occhi in cui viene danneggiato il centro della visione
distinta, vale a dire la macula ("macula lutea").
La DMS è la causa
principale della grave perdita dell’acutezza visiva (acuità visiva)
nella popolazione occidentale di età superiore a 65 anni. La macula sana
rende possibile sia la visione distinta sia la visione dei colori.
Finora non esiste ancora alcuna terapia in grado di guarire tale
malattia. Spesso si può però impedire o per lo meno ritardare la
progressione della DMS grazie a un'appropriata terapia commisurata allo
stadio della malattia.
Fondamentalmente si distinguono due forme di
DMS: quella secca (non neovascolare, vale a dire senza neoformazione di
vasi sanguigni) e la DMS umida, più aggressiva (neovascolare, ossia con
neoformazione di vasi sanguigni).
Il processo che precede entrambe le
forme è il decadimento dell'epitelio pigmentato della retina, che
controlla il nutrimento delle cellule della macula.
Nozioni fondamenti sulla DMS
La macula dell'occhio sano è formata da fotorecettori che sono disposti in strato al di sopra dell'epitelio pigmentato retinico e della coroide (figure 1 e 2). La coroide è ricca di vasi sanguigni e fornisce ossigeno e sostanze nutritive alla macula attraverso l'epitelio pigmentato retinico, che ha anche la funzione di trasportare via i prodotti tossici del metabolismo cellulare (scarti delle cellule) affinché siano eliminati.
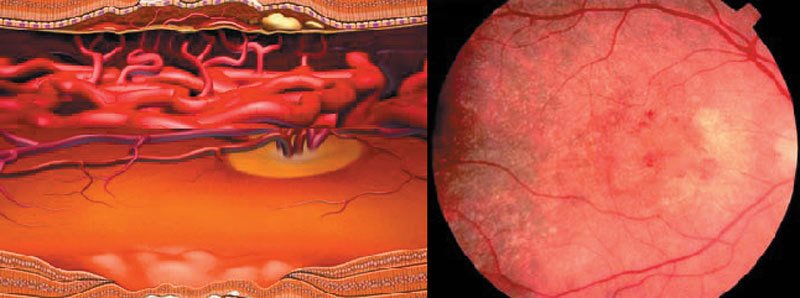 Sinistra: rappresentazione schematica della sezione trasversale di una
retina normale (parte periferica), con fotorecettori, epitelio
pigmentato retinico e coroide.
Sinistra: rappresentazione schematica della sezione trasversale di una
retina normale (parte periferica), con fotorecettori, epitelio
pigmentato retinico e coroide. Destra: rappresentazione schematica di un reperto normale, con macula sana.
Col passare degli anni il numero di cellule dell'epitelio retinico diminuisce.
Se
l'epitelio retinico perde un numero (troppo) alto di cellule (prestadio
della DMS), non è più in grado di far passare abbastanza ossigeno e
sostanze nutritive alla macula né di trasportare via i prodotti tossici
di scarto del metabolismo, per cui le cellule della macula soffrono per
"scarsa nutrizione" e "intossicazione", favorendo l'inizio della DMS
(secca). Quanto prima inizia una adeguata terapia (vedi oltre), ossia
quanto minore è il numero di cellule sensoriali già perse all'inizio del
trattamento, tanto più agevole sarà contenere e ritardare la DMS e,
quindi, il peggioramento della capacità visiva, associato a conseguenze
per lo più gravose per la qualità della vita.
Dato che la DMS, come
già menzionato, non può guarire, ma può essere senz'altro arrestata, è
particolarmente importante arrivare a una diagnosi e a una terapia
precoci.
Causa della DMS
L’esatta
causa della DMS non è ancora conosciuta. Perché si sviluppi la DMS
devono probabilmente concorrere diversi fattori. A partire dal 50° anno
di età aumenta la probabilità di ammalarsi di DMS.
Il meccanismo
decisivo alla base della morte delle cellule sensoriali della macula è
la riduzione dell'apporto di ossigeno e sostanze nutritive e l'accumulo
di prodotti tossici del metabolismo. La causa di questo processo è la
degenerazione dell'epitelio pigmentato retinico a seguito del crescente
stress ossidativo (aumentata formazione di radicali liberi). Se sono
colpite molte cellule dell'epitelio pigmentato retinico, questo strato
di cellule non può più rifornire la macula con una sufficiente quantità
di ossigeno e sostanze nutritive, né trasportare via completamente i
prodotti di scarto del metabolismo della macula, per cui questi
cataboliti si depositano al di sotto dell'epitelio pigmentato retinico a
livello di macula sotto forma di cosiddetti "corpi colloidi". La
situazione nutritiva della macula peggiora sempre più e le sue cellule
soffrono di "carenze nutritive" e "intossicazione", morendo e dando
inizio alla DMS (secca).
La DMS secca
La DMS secca esordisce con la perdita dell'epitelio pigmentato retinico, che precede la riduzione della capacità visiva. A poco a poco i depositi sottostanti alla retina (i cosiddetti "corpi colloidi") aumentano di numero e dimensioni, e i vasi sanguigni che riforniscono la macula degenerano (disturbo della microcircolazione). La conseguenza di questo processo è la morte delle cellule sensoriali della macula. Quando la perdita cellulare e la formazione di depositi hanno raggiunto una soglia critica, la capacità visiva peggiora drasticamente. Lo stadio finale è la cosiddetta atrofia geografica, con una perdita massiccia della capacità visiva.
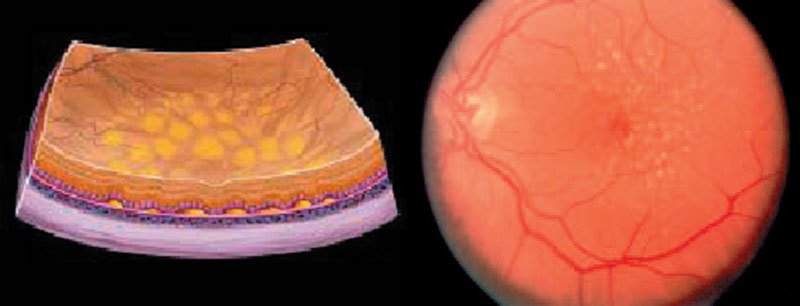
Sinistra: rappresentazione schematica delle alterazioni della retina di un occhio colpito da DMS secca (non neovascolare); sono rilevabili corpi colloidi, ossia prodotti di scarto del metabolismo maculare di colore giallastro non eliminati e dovuti alla degenerazione dell'epitelio pigmentato retinico al di sotto della macula (stress ossidativo per crescente formazione di radicali liberi conseguente a carenze nutritive).
Destra: immagine del fondo dell'occhio colpito da DMS secca (non neovascolare) con corpi colloidi.
Anche
se la malattia colpisce inizialmente "solo" un occhio, vi è il rischio
che con elevata probabilità la malattia interessi anche l'altro occhio
nel giro di pochi anni.
Nel 20-30% dei pazienti colpiti, la DMS
secca può evolvere in una forma umida, per cui è importante sottoporsi a
esami di controllo periodici presso l'oculista
(almeno una o due volte all'anno).
DMS umida
L'evoluzione dalla DMS secca a quella umida è contrassegnata dalla abnorme e incontrollata neoformazione di vasi sanguigni nella coroide (neovascolarizzazione coroideale, figure 5 e 6). Il processo fondamentale in cui si formano nuovi vasi sanguigni è denominato angiogenesi.
L'angiogenesi è un processo regolato
in cui vengono formati nuovi vasi sanguigni mediante ramificazione e
prolungamento di vasi sanguigni già presenti. Svolge un ruolo importante
in processi fisiologici (normali) quali la guarigione delle ferite, la
riparazione dei danni da ipossiemia (carenza di ossigeno) e la
riproduzione. In alcune malattie, come per es. il cancro, l'artrite, il
diabete mellito e le malattie oculari quali la DMS umida (neovascolare,
ossia con neoformazione di vasi sanguigni), si registra la presenza
continua di un disturbo (deregolazione) dell'angiogenesi.
L'angiogenesi è contraddistinta da una cascata di eventi: dapprima si
osserva dilatazione e aumento della permeabilità vascolare, a cui fa
seguito una degradazione locale di tessuto extracellulare. Ciò consente
alle cellule endoteliali attivate e proliferanti di migrare e formare
nuovi vasi. Si ritiene che questi nascenti vasi sanguigni vengano
sostenuti da una rete di cellule periendoteliali differenziate e matrice
extracellulare, prima di andare incontro a maturazione e rimodellamento
(Carmeliet et al, 1996; Folkman & Shing, 1992).
Il
fattore iniziale per l'angiogenesi nell'occhio è lo stress ossidativo
(maggior formazione di radicali liberi dovuta a carenze nutritive), in
grado di stimolare e far aumentare l'espressione del fattore di crescita
endoteliale vascolare A (VEGF-A). Questo processo induce la
proliferazione e la migrazione delle cellule endoteliali, la proteolisi e
la penetrazione della membrana basale, cui fa seguito l'invasione dei
vasi sanguigni al di sotto della macula. Il fattore di crescita
endoteliale vascolare A (VEGF-A) è una componente essenziale della
cascata angiogenetica e quindi un target importante per il trattamento
di determinati stadi dalla DMS umida (Das & McGuire, 2003; Witmer et
al, 2003).
Il VEGF-A è un fattore di
crescita con diverse caratteristiche: promuove la divisione cellulare
delle cellule endoteliali, è decisivo per la sopravvivenza di nuovi vasi
sanguigni ed è un fattore chemiotattico per le cellule infiammatorie.
Oltre a ciò, è conosciuto anche come "fattore di permeabilità vascolare"
(VPF), dato che regola anche la permeabilità dei vasi sanguigni.
Il
VEGF-A ha affinità per due recettori specifici (VEGFR) che si trovano
sulla superficie delle cellule endoteliali: VEGFR-1 e VEGFR-2 (Keyt et
al, 1996; Ferrara and Davis-Smyth, 1997). Il legame di VEGF-A a questi
recettori determina la crescita di cellule endoteliali e modifiche dei
legami tra di loro (cosiddette "tight junctions"; Aiello et al, 1995;
Ozaki et al, 2000), che fanno aumentare ulteriormente la permeabilità
dei vasi sanguigni (Antonetti et al, 1999).
Se
questi processi non vengono regolati, a partire dalla coroide crescono
vasi sanguigni anomali, che attraversano l'epitelio pigmentato retinico.
Questi nuovi vasi sanguigni abnormi lasciano fuoriuscire liquido e/o
sangue, causando il sollevamento dell'epitelio pigmentato retinico. Ciò
può a sua volta manifestarsi con metamorfopsia (visione di oggetti
deformati), scotoma centrale (deficit del campo visivo centrale) o
incapacità a leggere con l'occhio colpito.
A seguito della
fuoriuscita di sangue e liquido dai vasi neoformati della coroide al di
sotto della macula, si forma una cicatrice e, quindi, una perdita
funzionale ampia e irreversibile del tessuto colpito (perdita della
vista).

Sinistra: rappresentazione schematica delle alterazioni della retina e immagine del fondo di un occhio affetto ma DMS umida (neovascolare, essudativa). Il tratto distintivo della DMS umida è la crescita incontrollata di vasi sanguigni anomali della coroide al di sotto ed entro la macula.
Destra: immagine del fondo di un occhio affetto da DMS umida (neovascolare, essudativa), con fuoriuscita di sangue e liquido da vasi sanguigni anomali della coroide.
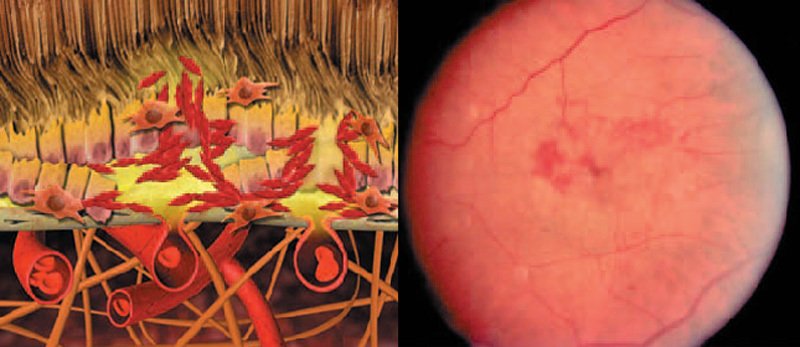
Sinistra: rappresentazione schematica delle alterazioni retiniche di un occhio con permeabilità vascolare e formazione di cicatrici discoidali nella DMS umida.
Destra: immagine del fondo di un occhio con permeabilità vascolare e formazione di cicatrici discoidali nella DMS umida.
Decorso della DMS
Il decorso della DMS dipende dalla sua forma: secca piuttosto che umida.
La DMS umida è la forma che minaccia maggiormente la capacità visiva.
Il suo decorso è più rapido e aggressivo, ma questa forma è anche molto
più rara, colpendo circa il 5% degli ultrasessantenni.
La DMS secca
progredisce in genere più lentamente, talvolta anche nel corso di anni.
La DMS secca può naturalmente evolvere in una forma umida.
La
progressione della DMS è complessa e può comprendere il passaggio dalla
forma secca (non neovascolare) a quella umida (neovascolare,
essudativa), con neoformazione di vasi sanguigni della coroide
(neovascolarizzazione coroideale) e associate alterazioni anatomiche
della retina e dell'epitelio pigmentato retinico.
La formazione di
una cicatrice discoidale è la conseguenza della fuoriuscita di sangue e
liquido dai vasi neoformati della coroide al di sotto ed entro la macula
(figure 7 e 8). Questa cicatrice si presenta comunemente come una
lesione bianca o bianco-giallastra, fibrosa, in genere rotonda e
prominente. Emorragie fresche al margine della cicatrice indicano una
neoangiogenesi della coroide recidivante o persistente.
La progressione della DMS può avere un decorso rapido. Negli studi
clinici, inizialmente non era in grado di leggere il 2,9% dei pazienti
non trattati, mentre dopo 3 mesi la percentuale era salita al 13,4% e,
dopo 24 mesi, al 46,3% (Macular Photocoagulation Study Group, 1991).
Nel corso della DMS si riscontrano distorsione e annebbiamento crescenti della vista.
In circa il 40% dei pazienti con DMS umida a carico di un occhio, è
probabile che nel giro di 5 anni si sviluppi la malattia anche all'altro
occhio (Macular Photocoagulation Study Group, 1993).
Nella DMS
avanzata, la lettura, il riconoscimento dei volti e le attività
quotidiane quali fare la spesa o guidare l'automobile risultano
impossibili, limitando l'autonomia.
Nei settori periferici del campo visivo la capacità visiva rimane inalterata, e non si sviluppa mai una cecità completa.
In teoria, per rilevare la DMS prima dell'insorgenza di limitazioni
funzionali, ma anche per riconoscere tempestivamente i peggioramenti o
il passaggio della DMS secca alla forma umida, sono necessari esami di
controllo periodici.
Segni precoci della DMS
Nello
stadio iniziale, il paziente per lo più non si accorge di nulla, dato
che la DMS ha un decorso indolore. Inizialmente l'acuità visiva
dell'occhio interessato spesso non è limitata o lo è solo minimamente,
sebbene possa esistere una perdita notevole e progressiva dell'epitelio
pigmentato retinico (prestadio della DMS). Anche in caso di capacità
visiva in calo, ossia quando la malattia si rende manifesta già con una
perdita funzionale a carico di un occhio, l'occhio sano spesso riesce a
compensare il deficit visivo dell'occhio malato, per cui di frequente il
paziente si accorge della DMS solo in uno stadio tardivo.
Pertanto,
a partire dai 50 anni di età è di particolare importanza far
controllare regolarmente il fondo dell'occhio da parte di uno
specialista della macula. La bravura medica consiste nel riconoscere
precocemente minime alterazioni dell'epitelio pigmentato retinico,
identificare altre possibili cause, escludere malattie e/o degenerazioni
e istituire precocemente, vale a dire possibilmente prima
dell'insorgenza di limitazioni funzionali (prima della riduzione della
capacità visiva), la migliore terapia del caso per impedire che la
perdita della capacità visiva progredisca. Quanto prima viene
riconosciuta la DMS, tanto migliori saranno le probabilità di contenerne
la progressione mediante terapie individuali mirate in base a forma e
stadio della malattia, riducendo al minimo le limitazioni visive o
prevenendole del tutto.
Se la perdita della vista è già subentrata,
in genere ha un carattere irreversibile, poiché in questo stadio della
malattia risultano già morte le cellule sensoriali necessarie al
processo visivo.
Segni della DMS avanzata (clinicamente manifesta)
Vista annebbiata e indistinta
Immagini distorte (metamorfopsie)
Le linee rette appaiono curve
Problemi crescenti alla lettura e nell'adattamento al buio
I colori appaiono più tenui
Percezione visiva limitata (macchia grigia) o mancante (macchia nera) al centro del campo visivo (cosiddetti scotomi)
Fattori di rischio della DMS
Età
La
prevalenza della DMS aumenta vertiginosamente con l'età
(Framingham-Studie, Beaver Dam Eye Study, Netherlands Rotterdam Eye
Study).
Dai 60 anni di età soffre di DMS secca circa una persona su
quattro. Approssimativamente il 18% delle persone tra 70 e 74 anni di
età presenta una forma di DMS. La DMS viene riscontrata nel 47% delle
persone al di sopra di 85 anni di età. In circa il 90% dei casi è
presente una DMS secca. A 55-64 anni di età, lo 0,1% delle persone è
affetto da DMS umida, mentre a partire da 85 anni di età la percentuale
raggiunge il 7% (Ferris et al, 1984; Klein et al, 1992; Vingerling et
al, 1995).
Genetica
La DMS è per lo meno parzialmente una
malattia ereditaria, come dimostra l'aumento della morbilità nei
familiari di primo grado di pazienti con DMS rilevato negli studi (Klein
et al, 1992). Se un familiare di primo grado soffre di DMS, anche gli
altri membri della famiglia hanno un rischio elevato di ammalarsi di
DMS.
Sesso
Se si considerano tutte le forme di DMS, uomini e
donne sono colpiti all'incirca in percentuali simili, anche se la forma
umida della DMS si manifesta più di frequente nelle donne, soprattutto
oltre i 75 anni di età (Klein et al, 1997).
Consumo di sigarette
Il fumo di sigaretta aumenta il rischio di ammalarsi di DMS in modo proporzionale alla dose.
I fumatori che fumano circa 20 o più sigarette al giorno hanno un
rischio 23 volte più elevato di ammalarsi di DMS con perdita della
capacità visiva, rispetto alle persone che non hanno mai fumato (AREDS
Study Research Group, 2000).
Origine etnica
La DMS è più frequente nei soggetti di razza caucasica che negli asiatici o negli afroamericani (Klein et al, 2003).
Colore dell'iride
Vi sono evidenze che le persone con colore chiaro dell'iride si ammalino di DMS più di frequente.
Alimentazione con pochi antiossidanti
Nei pazienti che assumono solo piccole quantità di antiossidanti e
luteina, il tasso di prevalenza della DMS è all'incirca doppio rispetto
ai pazienti che consumano elevate quantità di tali sostanze (Oshinskie,
1996; AREDS Study Research Group, 2001; i principi attivi vengono
illustrati in precedenza nel testo).
Valori elevati di colesterolo (Vingerling et al, 1995)
Ipertensione arteriosa (AREDS Study Research Group, 2000)
Malattie cardiovascolari (AREDS Study Research Group, 2000)
Luce UV (Nilsson et al, 2003; Rezai et al, 2008)
Qualità di vita nella DMS
Sebbene
la DMS causi raramente una cecità completa quando colpisce entrambi gli
occhi, la capacità del paziente di svolgere le attività quotidiane
dipendenti dalla vista, quali leggere, gestire il denaro, leggere l'ora,
riconoscere i volti e guidare l'automobile, è fortemente compromessa o
non più possibile. Di conseguenza, si osserva anche un netto calo della
qualità di vita delle persone colpite. La scomparsa della capacità
visiva, che causa perdita dell'autonomia (la compromissione della vista
può ridurre la mobilità e aumentare il rischio di lesioni, per es. per
cadute) e riduzione dell'autostima, limita molto i pazienti e può essere
all'origine di depressioni.
Le stime indicano che la DMS lieve è
motivo di una riduzione della qualità della vita pari al 17%. Nelle
forme di DMS moderate e gravi, la qualità della vita si riduce
rispettivamente del 40% e di più del 60% (Brown et al, 2005).
La
gravità delle limitazioni causate dalla DMS viene considerata dai
pazienti esattamente come quella di altre malattie invalidanti croniche
quali per es. l'artrite, la broncopneumopatia cronica ostruttiva e
l'AIDS (Acquired Immune Deficiency Syndrome) (Williams et al, 1998;
Brody et al, 2001).
Esami nella DMS
Se si sospetta una DMS è necessario un esame della macula. Questi esami sono indolori e vengono condotti con apparecchiature specifiche (lampada a fessura, lenti, oftalmoscopio) dopo dilatazione della pupilla (gocce oculari). Se gli esami evidenziano alterazioni specifiche (figure 3-8), per es. depositi patologici di tipici prodotti di degradazione lipidici giallastri (corpi colloidi), neoformazione patologica di vasi sanguigni o fuoriuscita di sangue e/o liquidi (tutti segni di DMS), possono rivelarsi necessari ulteriori esami:
Tomografia ottica a coerenza di fase (OCT), per la determinazione delle condizioni e dello spessore della retina
Documentazione dello stato del fondo oculare (immagini fotografiche)
Rappresentazione dei vasi sanguigni (angiografia con fluoresceina o verde indocianina)
In genere si esegue dapprima un esame speciale per immagini (tomografia
ottica a coerenza di fase, OCT), cui segue l'angiografia a
fluorescenza. L'angiografia a fluorescenza è un esame speciale con uso
di colorante che aiuta a differenziare la DMS (forma e stadio) e
facilita il riconoscimento e la valutazione della crescita anomala di
vasi sanguigni. Se si sospetta una forma specifica di DMS umida, può
essere vantaggioso rappresentare i vasi sanguigni con il verde
indocianina (un altro colorante).
La tomografia ottica a coerenza di
fase è un procedimento laser tridimensionale indolore che rende
possibile un esame per strati ad alta risoluzione senza necessità di
contatto, e serve a riconoscere le alterazioni microstrutturali della
macula. Combinando l'angiografia e la tomografia ottica a coerenza di
fase, lo specialista della macula è in grado di riconoscere strutture
patologiche specifiche dell'occhio e con ciò calcolare e analizzare
esattamente il tipo e l'entità dei depositi patologici di prodotti del
metabolismo. Ciò consente di valutare il decorso individuale della DMS e
controllare il successo terapeutico.
Trattamento della DMS
La guarigione della DMS rimane finora ancora preclusa, e non esiste una protezione garantita da questa malattia.
Il più importante obiettivo del trattamento della DMS consiste
nell'arrestare il decorso naturale della malattia (precocemente, nel
migliore dei casi prima che abbia inizio la perdita della vista, ossia
con alterazioni incipienti dell'epitelio pigmentato retinico) e
conservare la più elevata capacità visiva possibile.
A questo scopo
si è dimostrato efficace, nei non fumatori, l'apporto di determinati
principi attivi termolabili di elevato valore nutritivo e con alta
biodisponibilità (acido DL-alfa-lipoico, zeaxantina, luteina,
levocarnitina, acido pantotenico, piridin-3-carbamide, tiamina,
riboflavina, 3-idrossi-2-metilpiridina, vit. B6, acido
pteroilglutammico, biotina, cianocobalamina) (Age-Related Eye Disease
Study Research Group, 2007; Briganti et al, 2008; Feher et al, 2005; Kim
et al, 2008; Johnson et al, 2008; Parisi et al, 2008; Zulkhairi et al,
2008)
Oltre a ciò, il trattamento della DMS dipende dalla forma presente (DMS secca o umida) e dallo stadio della malattia.
Trattamento della DMS secca
Nella
DMS secca è presente tra l'altro un disturbo della microcircolazione
della retina (vedi sopra), che riduce l'apporto di ossigeno e sostanze
nutritive alla macula. Per mantenere la funzionalità della macula e,
quindi, la capacità visiva centrale, è necessario che la macula venga
rifornita per tutta la vita con determinate sostanze nutritive e
principi attivi (vedi sopra) e che al di sotto di essa la circolazione
sanguigna nei capillari sia sufficiente. Col passare del tempo la DMS
secca provoca una perdita progressiva dell'epitelio pigmentato retinico e
un netto peggioramento della circolazione sanguigna della macula: la
perdita funzionale dell'epitelio pigmentato retinico causa la formazione
di depositi di prodotti del metabolismo (cosiddetti corpi colloidi)
immediatamente al di sotto della macula, che riducono ulteriormente
l'apporto di sostanze nutritive e quindi la funzionalità della macula,
con conseguente peggioramento crescente della capacità visiva centrale.
Nello stadio tardivo della DMS secca, a seguito della morte
dell'epitelio pigmentato retinico, le cellule sensoriali della macula
vanno irrimediabilmente perdute (cosiddetta atrofia geografica), e la
vista centrale subisce un netto peggioramento.
In alcune forme precoci di DMS secca, oltre all'apporto dei principi attivi menzionati sopra può giovare anche la reoferesi.
Reoferesi nella DMS
Gli
studi scientifici dimostrano che oltre alla terapia con determinati
principi attivi (vedi sopra), i pazienti affetti da DMS secca possono
trarre giovamento anche dal miglioramento delle proprietà reologiche
(relative al flusso) del sangue (Brunner et al, 2000; Kirchhof 2004;
Klingel et al, 2003; Klingel et al, 2006; Pulido et al, 2005).
Questa terapia viene denominata reoferesi, e il suo scopo è quello di stabilizzare e migliorare la capacità visiva centrale.
La reoferesi costituisce un trattamento del sangue che si svolge
esternamente al corpo. Questo trattamento è assimilabile a un
procedimento di filtrazione, mediante il quale vengono eliminate
determinate componenti del sangue (per es. alcuni grassi e proteine) che
esercitano un effetto sfavorevole sulle sue proprietà reologiche. Al
termine della procedura il paziente riceve di nuovo il proprio sangue
"purificato", mentre gli elementi estranei non vengono riutilizzati.
Esiste tutta una serie di procedimenti simili per il trattamento del
sangue esternamente al corpo, che vengono impiegati di routine da
decenni nelle malattie dei reni e del metabolismo.
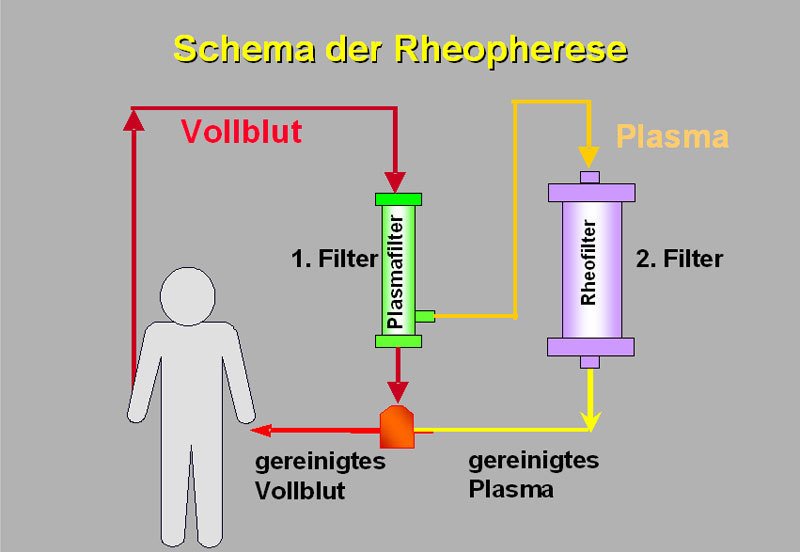
Rappresentazione schematica della reoferesi
Un trattamento di reoferesi dura circa 2-3 ore. Durante questo periodo di tempo il paziente giace comodamente a letto. Sulle braccia vengono praticati due accessi venosi alla circolazione sanguigna. Il sangue viene deviato in un circuito di tubi e passa attraverso due filtri (vedi figura 9). In questo circuito chiuso esterno al corpo si trova sempre solo una quantità limitata di sangue. I tubi del circuito e i filtri sono prodotti monouso sterili. Il sangue purificato viene restituito al corpo attraverso la seconda vena.
Trattamento della DMS umida
In
passato la DMS umida è stata trattata con fotocoagulazione laser,
radioterapia o intervento chirurgico, ma i risultati di questi metodi
erano spesso insoddisfacenti. Gli approcci farmacologici più recenti,
quali l'uso di verteporfina (Visudyne®), impiegata nella terapia
fotodinamica (PDT), o di pegaptanib sodico (Macugen®), un aptamero
anti-VEGF-A165-RNA, hanno conseguito risultati più durevoli, e spesso è
stato possibile raggiungere la stabilizzazione della capacità visiva,
definita come perdita di meno di 15 lettere sulla tavola ETDRS (Early
Treatment Diabetic Retinopathy Study).
Antagonisti del VEGF più
recenti (per es. i frammenti Fab di anticorpi monoclonali) sono in grado
di inibire specificamente l'angiogenesi alterata (deregolata), colpendo
il meccanismo fondamentale della crescita di vasi sanguigni patologici
nella coroide. Similmente si può arrestare e bloccare la fuoriuscita di
sangue e liquido nell'epitelio pigmentato retinico, che provoca danni e
formazioni cicatriziali nelle cellule sensoriali e, di conseguenza,
perdita della vista irreversibile.
Il meccanismo d'azione si basa
sul blocco dei recettori del fattore di crescita endoteliale vascolare A
(VEGF-A) sulla superficie delle cellule endoteliali che formano i vasi
sanguigni della coroide. Nella DMS umida i valori di VEGF-A sono
elevati. La regolazione di questo fattore di crescita impedisce tra
l'altro l'attivazione della cascata di reazioni che portano alla
neoformazione di vasi sanguigni della coroide e alla fuoriuscita di
liquido.
Recenti studi di fase III, randomizzati e controllati,
(MARINA e ANCHOR) hanno dimostrato un miglioramento dell'acuità visiva
media nei primi tre mesi di trattamento, che ha potuto essere mantenuta
per l'intero periodo di trattamento. Sembra che tali effetti siano da
attribuire alla riduzione rapida e duratura del gonfiore della retina e
della fuoriuscita di liquido.
Mediante questa terapia si può in
genere arrestare la progressione naturale della DMS umida fino alla
cecità (ai sensi di legge).
La terapia inizia con una fase di
saturazione (upload) di tre iniezioni di sostanza antiproliferativa
(inibitore del VEGF) nel corpo vitreo (iniezione intravitreale)
dell'occhio colpito eseguite a intervalli mensili, seguite da una fase
di mantenimento in cui viene controllata una volta al mese l'acuità
visiva del paziente. In base ai rilievi possono rendersi necessarie
altre iniezioni.
Un vantaggio dell'iniezione nell'occhio è il fatto
che il principio attivo raggiunge direttamente la macula, ossia la sede
in cui deve agire. Se il paziente assumesse il principio attivo sotto
forma di compresse, dovrebbe introdurre una dose sostanzialmente più
elevata, dato che la macula assorbe dal sangue solo piccole quantità
della sostanza. Oltre a ciò, tutto il corpo sarebbe esposto al principio
attivo a dosaggio elevato, che potrebbe causare effetti collaterali.
L'iniezione può essere effettuata ambulatorialmente, deve essere
eseguita in condizioni sterili controllate (in sala operatoria) e il
paziente dovrebbe usare gocce antibiotiche 3 giorni prima e 3 giorni
dopo l'iniezione. Per una settimana dopo l'iniezione si dovrebbero
eseguire controlli oftalmologici in funzione dei risultati ottenuti,
anche in caso di assenza di disturbi.
Successivamente all'iniezione
intraoculare si può manifestare offuscamento della vista. Dopo
l'intervento il paziente non deve guidare veicoli né usare macchinari
per tutto il tempo in cui persiste questo sintomo.
In caso di segni
di infezione (arrossamento dell'occhio, dolore, fotosensibilità o
alterazione della capacità visiva), il paziente deve mettersi
immediatamente in contatto con lo specialista della macula che lo sta
trattando.
Misure applicabili dal paziente nella DMS
Sebbene non esista una protezione assoluta dalla DMS, i comportamenti seguenti possono prevenirla:
Uso di occhiali da sole con 100% di protezione UV e astine larghe,
affinché anche la luce laterale non possa raggiungere gli occhi.
Sottoporsi a esami di controllo periodici del fondo oculare.
Eseguire regolarmente un autotest della capacità visiva con l'ausilio del cosiddetto reticolo di Amsler.
Assumere principi attivi adeguati, tra cui antiossidanti (non nei fumatori).
Rinunciare al fumo.
Seguire un'alimentazione equilibrata (frutta, verdura e pesce).
Far controllare dal medico la pressione arteriosa ed eventualmente assumere una terapia appropriata.
Far controllare dal medico il profilo lipidico ed eventualmente abbassare il livello dei grassi del sangue.
Ogni cambiamento della capacità visiva dovrebbe essere diagnosticato ed eventualmente trattato il più presto possibile.
Come già menzionato, la DMS non può guarire, ma spesso può essere
arrestata o ritardata. Per questo motivo è particolarmente importante
arrivare a una diagnosi e una terapia precoci. Qualora fosse già
presente un prestadio della DMS o una DMS manifesta, la sola
"alimentazione sana" non è sufficiente e in genere si deve ricorrere a
una terapia.
Se è già affetto da DMS manifesta, è importante
riconoscere tempestivamente la transizione dalla forma secca a quella
umida, per riuscire a integrare e cambiare tempestivamente il Suo
trattamento.
Esami di controllo nella DMS
Gli esami di controllo dovrebbero essere concordati con lo specialista
della macula presso cui è in cura. In genere è necessario farsi
controllare almeno una o due volte all'anno.
Se è già presente una forma umida di DMS, i controlli dovrebbero avvenire di regola ogni tre o quattro mesi.
Se insorgono cambiamenti della capacità visiva (test di Amsler, vedi
sopra), ci si deve sottoporre al più presto a un controllo.